Reação Química De Dupla Troca E Exemplos – Mergulhe no fascinante mundo das Reações Químicas de Dupla Troca! Este guia exclusivo, elaborado com gaya persuasif kreatif, irá transportá-lo para um reino de conhecimento, onde a química ganha vida diante de seus olhos. Prepare-se para uma jornada de descobertas e insights esclarecedores sobre este fenômeno intrigante.
Descubra os tipos de reações de dupla troca, desde as mais simples até as mais complexas. Aprenda o mecanismo subjacente que impulsiona essas trocas iônicas e explore as diversas aplicações práticas que tornam essas reações essenciais em campos como medicina e agricultura.
Definição de Reação Química de Dupla Troca

As reações químicas de dupla troca, também conhecidas como reações de precipitação, ocorrem quando duas substâncias iônicas trocam íons para formar dois novos compostos.
Uma reação de dupla troca típica envolve a troca de cátions entre dois sais iônicos, resultando na formação de dois novos sais. Por exemplo, quando uma solução de cloreto de sódio (NaCl) é misturada com uma solução de nitrato de prata (AgNO3), ocorre a seguinte reação:
NaCl + AgNO3 → AgCl + NaNO3
Nessa reação, os íons sódio (Na+) do cloreto de sódio trocam de lugar com os íons prata (Ag+) do nitrato de prata, formando cloreto de prata (AgCl) e nitrato de sódio (NaNO3).
Tipos de Reações de Dupla Troca

As reações de dupla troca, também conhecidas como reações de precipitação ou reações de neutralização, são divididas em três tipos principais com base nos produtos formados:
Cada tipo possui características específicas que as diferenciam umas das outras.
Precipitação, Reação Química De Dupla Troca E Exemplos
Nesse tipo de reação de dupla troca, os produtos formam um precipitado sólido insolúvel em água. O precipitado se separa da solução, tornando a mistura turva ou opaca.
Exemplo:
AgNO3(aq) + NaCl(aq) → AgCl(s) + NaNO 3(aq)
Formação de Gás
Nesse tipo de reação, um dos produtos formados é um gás que escapa da solução. A formação de gás pode ser observada pela efervescência ou formação de bolhas na mistura.
Exemplo:
HCl(aq) + NaHCO3(aq) → NaCl(aq) + H 2O(l) + CO 2(g)
Neutralização
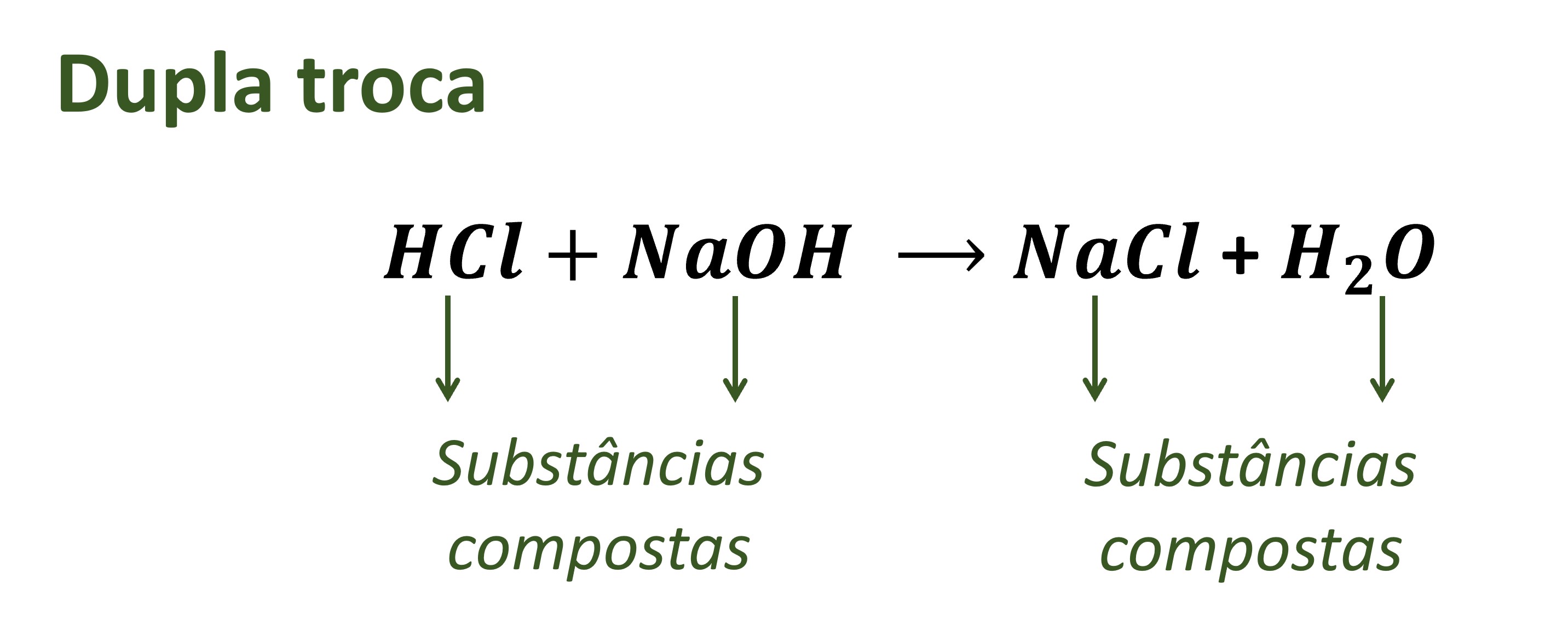
Nas reações de neutralização, os produtos formados são um sal e água. Essas reações ocorrem entre um ácido e uma base, resultando em uma solução neutra ou ligeiramente ácida ou básica.
Exemplo:
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l)
Mecanismo das Reações de Dupla Troca: Reação Química De Dupla Troca E Exemplos
As reações de dupla troca envolvem a troca de íons entre dois compostos iônicos. O mecanismo desta reação ocorre em várias etapas:
Dissolução
Os compostos iônicos são dissolvidos em um solvente, geralmente água. Os íons se dissociam dos compostos e se tornam solvatados, cercados por moléculas de solvente.
Formação do Complexo Ativado
Os íons solvatados colidem uns com os outros e formam um complexo ativado, que é uma estrutura de transição de alta energia.
Troca de Íons
No complexo ativado, os íons trocam de parceiros, formando novos compostos iônicos.
Separação
Os novos compostos iônicos se separam do complexo ativado e se tornam solvatados novamente.
Papel dos Íons
Os íons desempenham um papel crucial nas reações de dupla troca. Eles são as espécies que trocam de parceiros e formam novos compostos. A carga e o tamanho dos íons afetam a taxa e o equilíbrio da reação.
Aplicações das Reações de Dupla Troca

As reações de dupla troca encontram inúmeras aplicações práticas em diversos setores, incluindo medicina e agricultura.
Na Medicina
- Produção de medicamentos:As reações de dupla troca são usadas na síntese de uma ampla gama de medicamentos, como antibióticos, analgésicos e anti-inflamatórios.
- Diagnóstico médico:Algumas reações de dupla troca são usadas em testes diagnósticos para detectar a presença de íons específicos em fluidos corporais, como sangue e urina.
Na Agricultura
- Fertilização do solo:As reações de dupla troca são usadas na produção de fertilizantes, que fornecem nutrientes essenciais para as plantas.
- Controle de pragas:Algumas reações de dupla troca são usadas na produção de pesticidas, que ajudam a controlar pragas que podem danificar as plantações.
Exemplos de Reações de Dupla Troca

Para ilustrar melhor as reações de dupla troca, apresentamos uma tabela com exemplos específicos. Esses exemplos demonstram os reagentes envolvidos, os produtos formados e as equações químicas balanceadas correspondentes.
Tabela de Exemplos
| Reagentes | Produtos | Equação Química |
|---|---|---|
| NaCl (cloreto de sódio) + AgNO3 (nitrato de prata) | AgCl (cloreto de prata) + NaNO3 (nitrato de sódio) | NaCl + AgNO3 → AgCl + NaNO3 |
| CuSO4 (sulfato de cobre) + Ba(OH)2 (hidróxido de bário) | Cu(OH)2 (hidróxido de cobre) + BaSO4 (sulfato de bário) | CuSO4 + Ba(OH)2 → Cu(OH)2 + BaSO4 |
| FeCl3 (cloreto de ferro) + NaOH (hidróxido de sódio) | Fe(OH)3 (hidróxido de ferro) + NaCl (cloreto de sódio) | FeCl3 + NaOH → Fe(OH)3 + NaCl |
| Pb(NO3)2 (nitrato de chumbo) + KI (iodeto de potássio) | PbI2 (iodeto de chumbo) + KNO3 (nitrato de potássio) | Pb(NO3)2 + KI → PbI2 + KNO3 |
Ao concluirmos nossa exploração das Reações Químicas de Dupla Troca, esperamos que você tenha adquirido uma compreensão profunda deste conceito fundamental. Lembre-se, a química não é apenas uma ciência, mas também uma arte, onde os elementos se unem e se transformam, criando novas substâncias e possibilidades infinitas.
Continue sua jornada de descobertas científicas, expandindo seus conhecimentos e abraçando a maravilha do mundo químico.
Key Questions Answered
O que são Reações Químicas de Dupla Troca?
São reações químicas nas quais íons de dois compostos trocam de lugar, formando dois novos compostos.
Quais são os diferentes tipos de Reações de Dupla Troca?
Existem três tipos principais: precipitação, ácido-base e oxirredução.
Como as Reações de Dupla Troca são usadas na prática?
Elas são usadas em diversas aplicações, como purificação de água, produção de medicamentos e fabricação de fertilizantes.

