Modelo Atômico De Bohr – Todo Estudo: embarque conosco numa jornada fascinante pelo universo microscópico! Desvendaremos os segredos do átomo segundo a visão genial de Niels Bohr, explorando seus postulados, suas brilhantes aplicações e suas inevitáveis limitações. Preparado para desvendar a elegância e a complexidade do mundo quântico, passo a passo, desmistificando conceitos e revelando a beleza da ciência em ação?
Acompanhe-nos nesta exploração inesquecível da estrutura atômica, desde os modelos mais simples até as teorias quânticas mais modernas.
Adentraremos no coração da matéria, examinando a estrutura proposta por Bohr, onde elétrons orbitam o núcleo em níveis de energia específicos. Compararemos esse modelo com o de Rutherford, analisando suas diferenças cruciais e o impacto da quantização de energia. Veremos como os fótons desempenham um papel fundamental nas transições eletrônicas, gerando os espectros atômicos que tanto fascinaram os cientistas.
Exploraremos as aplicações bem-sucedidas do modelo, mas também suas limitações, especialmente quando aplicado a átomos mais complexos. Finalmente, faremos uma viagem até os modelos atômicos contemporâneos, baseados na mecânica quântica, compreendendo a evolução do nosso conhecimento sobre o átomo.
Conceitos Fundamentais do Modelo Atômico de Bohr
Imagine um universo microscópico, regido por leis elegantes e precisas, onde a dança dos elétrons ao redor do núcleo atômico revela a beleza da física quântica. O modelo atômico de Bohr, proposto em 1913, foi um marco nesse universo, oferecendo uma visão simplificada, porém profundamente reveladora, da estrutura atômica. Ele representou um avanço significativo em relação aos modelos anteriores, abrindo caminho para uma compreensão mais profunda do comportamento da matéria.
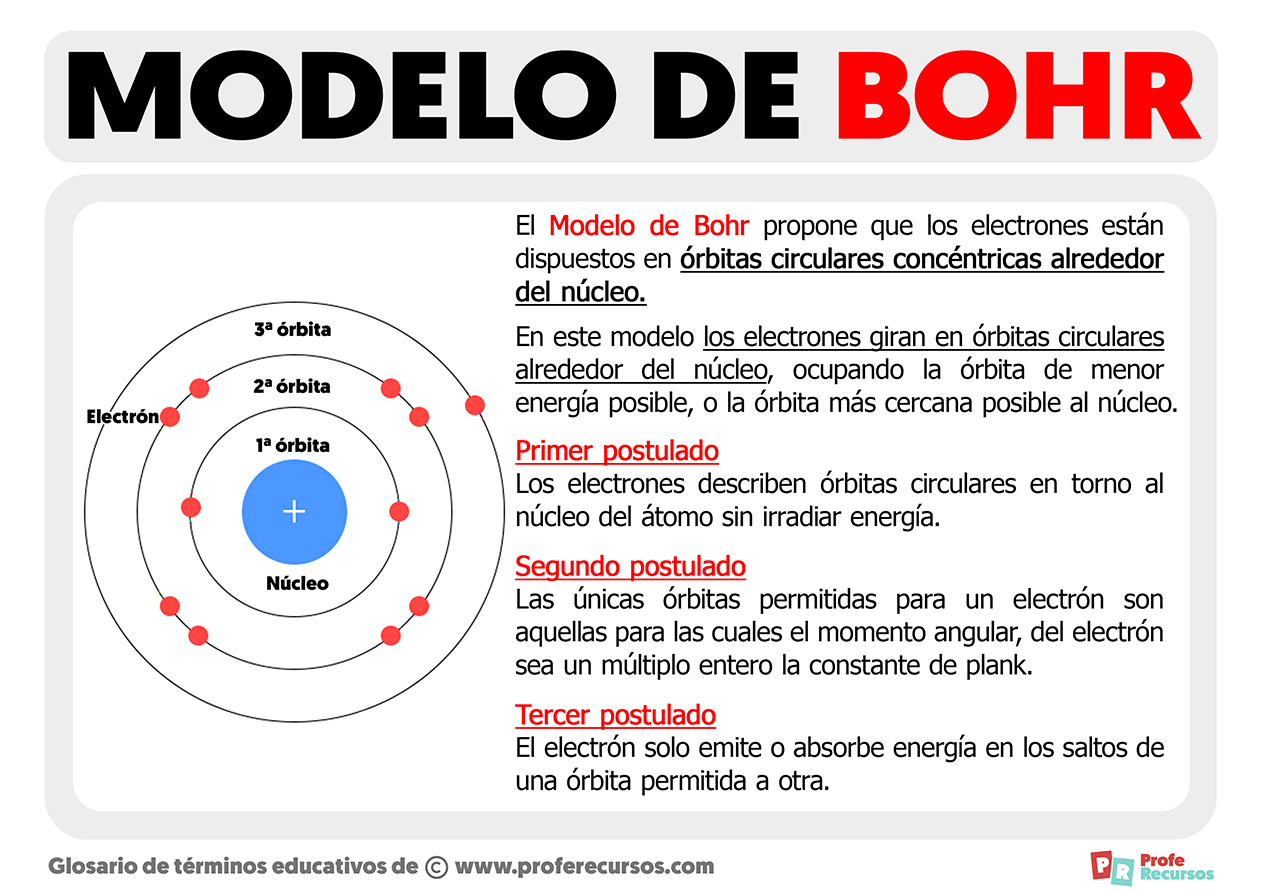
Estrutura Atômica segundo Bohr: Órbitas e Níveis de Energia
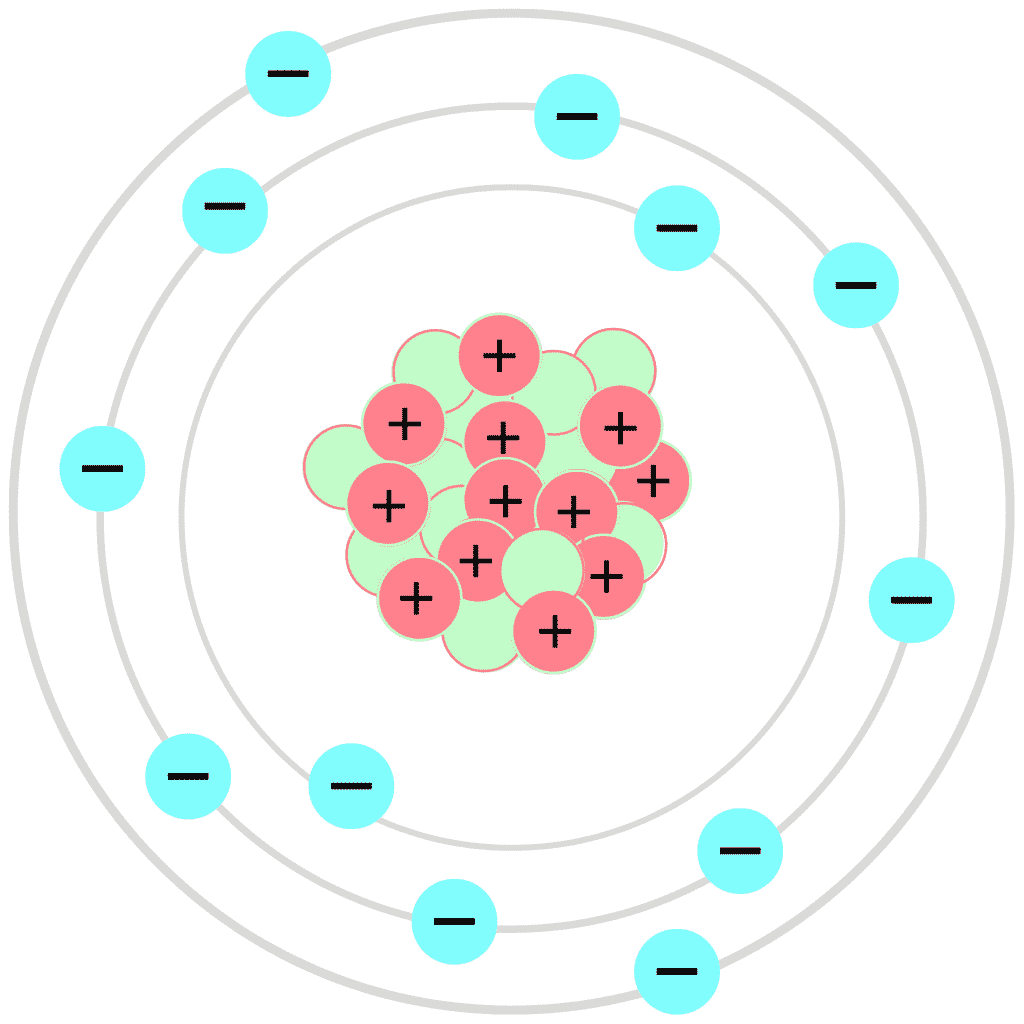
No modelo de Bohr, o átomo é concebido como um minúsculo sistema solar, com um núcleo denso e positivo no centro, orbitado por elétrons em trajetórias circulares bem definidas. Essas órbitas, porém, não são arbitrárias. Cada elétron ocupa uma órbita específica, associada a um nível de energia quantizado. Quanto mais distante do núcleo, maior a energia do elétron naquela órbita.
Essa organização em camadas energéticas, com elétrons ocupando níveis discretos, é uma característica fundamental do modelo e difere radicalmente da física clássica, onde a energia poderia assumir qualquer valor. Podemos visualizar isso como degraus de uma escada, onde um elétron pode estar em um degrau, mas não entre eles.
Quantização da Energia no Modelo de Bohr
A ideia revolucionária de Bohr reside na quantização da energia. Ao contrário do modelo clássico, onde os elétrons poderiam possuir qualquer energia, Bohr postulou que a energia dos elétrons é quantizada, ou seja, restrita a valores específicos. Essa quantização está diretamente relacionada à frequência da órbita eletrônica, sendo expressa pela equação:
En = -R H/n²
onde E n representa a energia do elétron no nível n, R H é a constante de Rydberg e n é o número quântico principal (n = 1, 2, 3…). Essa equação descreve a energia dos níveis de energia permitidos para o átomo de hidrogênio, o átomo mais simples. A quantização explica a estabilidade do átomo, pois um elétron em uma órbita permitida não emite radiação eletromagnética, ao contrário do que prevê a física clássica.
Comparação entre os Modelos de Bohr e Rutherford
O modelo de Bohr aprimora o modelo de Rutherford, que descrevia o átomo como um núcleo positivo cercado por uma nuvem difusa de elétrons. Rutherford não explicou a estabilidade do átomo, pois segundo a física clássica, um elétron em órbita acelerada deveria emitir radiação, perdendo energia e espiralando em direção ao núcleo. Bohr solucionou essa inconsistência introduzindo a quantização da energia, explicando por que os elétrons não colapsam no núcleo.
A principal diferença, portanto, reside na estabilidade atômica e na natureza quantizada da energia dos elétrons. O modelo de Rutherford é um modelo estático, enquanto o de Bohr introduz o movimento orbital quantizado dos elétrons.
Papel dos Fótons na Transição Eletrônica
As transições eletrônicas entre os diferentes níveis de energia são acompanhadas pela absorção ou emissão de fótons. Quando um elétron absorve um fóton com energia exatamente igual à diferença de energia entre dois níveis, ele salta para um nível de energia superior. Inversamente, quando um elétron retorna a um nível de energia inferior, ele emite um fóton com energia correspondente à diferença de energia entre os níveis.
A energia do fóton é dada por:
E = hν
onde E é a energia do fóton, h é a constante de Planck e ν é a frequência da radiação eletromagnética. Este processo explica as linhas espectrais observadas nos espectros atômicos, cada linha correspondendo a uma transição eletrônica específica. A análise dessas linhas espectrais fornece informações cruciais sobre a estrutura atômica.
Postulados do Modelo Atômico de Bohr, Modelo Atômico De Bohr – Todo Estudo
A essência do modelo de Bohr reside em seus postulados fundamentais. Eles fornecem a base para a compreensão da estrutura e do comportamento atômico, mesmo com suas limitações.
| Postulado | Descrição | Implicações | Limitações |
|---|---|---|---|
| Os elétrons movem-se em órbitas circulares ao redor do núcleo. | Os elétrons orbitam o núcleo em trajetórias circulares específicas. | Define a estrutura orbital do átomo. | Não explica a forma das órbitas em átomos mais complexos. |
| Apenas algumas órbitas são permitidas. | Os elétrons só podem existir em órbitas com energia quantizada. | Explica a estabilidade do átomo e a quantização da energia. | Não explica a existência de subníveis de energia. |
| Um elétron em uma órbita permitida não emite radiação. | Enquanto em uma órbita permitida, o elétron não perde energia. | Resolve o problema da instabilidade atômica do modelo de Rutherford. | Contradiz a física clássica, que prevê emissão de radiação por cargas aceleradas. |
| A transição entre órbitas envolve absorção ou emissão de fótons. | A mudança de órbita implica na absorção ou emissão de energia na forma de fótons. | Explica o espectro de linhas atômicas. | Não explica a intensidade das linhas espectrais. |
Aplicações e Limitações do Modelo de Bohr: Modelo Atômico De Bohr – Todo Estudo
O modelo atômico de Bohr, apesar de suas limitações, representou um avanço monumental na compreensão da estrutura atômica, fornecendo uma explicação elegante e relativamente simples para fenômenos que até então permaneciam enigmáticos. Sua capacidade de prever com precisão certas propriedades atômicas, especialmente para o átomo de hidrogênio, o consagrou como um marco na história da física, mesmo que sua validade fosse limitada.
Ele pavimentou o caminho para a mecânica quântica, fornecendo uma base intuitiva para conceitos mais complexos que surgiriam posteriormente.
Sucessos do Modelo de Bohr na Explicação de Espectros Atômicos
O triunfo mais notável do modelo de Bohr reside na sua capacidade de explicar o espectro de emissão do átomo de hidrogênio. Ao postular que os elétrons orbitam o núcleo em níveis de energia quantizados, Bohr conseguiu prever com precisão as frequências das linhas espectrais observadas experimentalmente. Esta concordância entre teoria e experimento foi um feito extraordinário, confirmando a natureza quantizada da energia atômica e fornecendo evidências cruciais para a emergência da mecânica quântica.
A simplicidade do modelo permitiu cálculos relativamente acessíveis, tornando-o um instrumento valioso para o ensino e a compreensão inicial de conceitos quânticos.
Limitações do Modelo de Bohr, Especialmente em Relação a Átomos Polietetrônicos
Apesar de seu sucesso com o hidrogênio, o modelo de Bohr apresenta sérias limitações quando aplicado a átomos com mais de um elétron (átomos polietetrônicos). A principal falha reside na incapacidade de considerar as interações elétron-elétron. O modelo assume que cada elétron orbita o núcleo independentemente, ignorando as forças de repulsão eletrostática entre eles. Esta simplificação resulta em previsões incorretas para as energias dos níveis de energia e para os espectros de emissão desses átomos.
A complexidade das interações entre múltiplos elétrons torna o modelo de Bohr inadequado para descrever com precisão a estrutura e o comportamento desses sistemas atômicos mais complexos.
Contribuição do Modelo de Bohr para o Desenvolvimento da Mecânica Quântica
O modelo de Bohr, apesar de suas limitações, foi crucial para o desenvolvimento da mecânica quântica. Sua introdução dos níveis de energia quantizados e da quantização do momento angular forneceu um passo fundamental para a compreensão da natureza quantizada do mundo microscópico. Ele serviu como um trampolim, um modelo intermediário, que inspirou e guiou físicos como Schrödinger e Heisenberg na formulação de teorias mais completas e sofisticadas, como a mecânica ondulatória e a mecânica matricial, que superaram as deficiências do modelo de Bohr.
Sua simplicidade e capacidade de explicar, pelo menos parcialmente, o espectro do hidrogênio, ajudaram a estabelecer a ideia fundamental de que a energia nos átomos não é contínua, mas sim quantizada.
Comparação do Espectro de Emissão do Hidrogênio Previsto pelo Modelo de Bohr com Dados Experimentais
A concordância entre as previsões do modelo de Bohr e os dados experimentais para o átomo de hidrogênio é impressionante, embora não perfeita. O modelo previu com grande precisão as posições das linhas espectrais da série de Lyman, Balmer e Paschen.
- Série de Lyman (ultravioleta): O modelo de Bohr previu com alta precisão as frequências das linhas espectrais, confirmando a sua capacidade de descrever as transições eletrônicas para o nível fundamental (n=1).
- Série de Balmer (visível): As previsões do modelo para esta série também se mostraram extremamente precisas, sendo amplamente consistentes com as observações experimentais, principalmente para as linhas mais proeminentes.
- Série de Paschen (infravermelho): A concordância entre as previsões teóricas e os dados experimentais para esta série também foi significativa, reforçando a validade do modelo, ainda que com algumas pequenas discrepâncias.
É importante notar que pequenas discrepâncias entre as previsões do modelo e os dados experimentais, particularmente em linhas espectrais de alta precisão, foram posteriormente explicadas pela mecânica quântica mais completa.
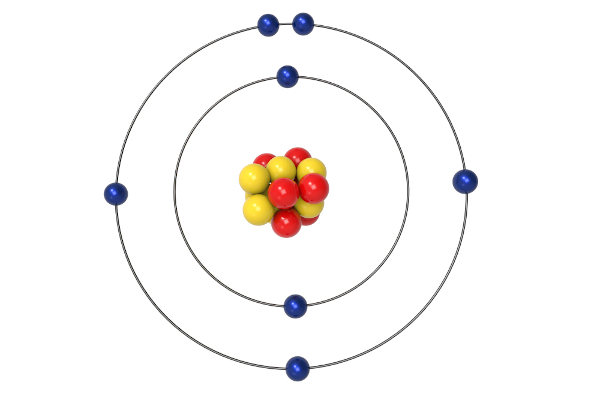
Representação Gráfica do Átomo de Hidrogênio Segundo Bohr
A representação gráfica do átomo de hidrogênio segundo Bohr mostra um núcleo central (próton) com carga positiva, ao redor do qual um único elétron orbita em trajetórias circulares bem definidas. Cada órbita corresponde a um nível de energia quantizado, representado por um número quântico principal (n). A órbita mais próxima do núcleo (n=1) possui a menor energia e representa o estado fundamental.
Órbitas mais distantes do núcleo (n=2, 3, 4…) correspondem a níveis de energia mais altos e estados excitados. As transições entre estas órbitas são responsáveis pela emissão ou absorção de fótons de energia específica, resultando no espectro de emissão discreto observado. A imagem mostra círculos concêntricos representando as diferentes órbitas permitidas, com o elétron se movendo em uma delas.
O núcleo, um pequeno ponto no centro, representa o próton. A distância entre o núcleo e o elétron em cada órbita é proporcional ao número quântico principal (n), e a energia de cada órbita é inversamente proporcional a n².
Evolução do Modelo Atômico após Bohr
A jornada da compreensão da estrutura atômica, iniciada com o modelo de Bohr, foi uma aventura científica repleta de descobertas surpreendentes e refinamentos teóricos. O modelo de Bohr, embora revolucionário para sua época, apresentava limitações que impulsionaram a busca por uma descrição mais precisa e completa do átomo. Esta busca nos levou ao fascinante mundo da mecânica quântica, um universo regido por leis que desafiam a intuição clássica.
O Surgimento da Mecânica Quântica e suas Implicações para o Modelo Atômico
O modelo de Bohr, com suas órbitas eletrônicas bem definidas, era uma simplificação elegante, mas insuficiente para explicar fenômenos observados experimentalmente, como os espectros atômicos de átomos mais complexos que o hidrogênio. A solução veio com o desenvolvimento da mecânica quântica, uma teoria revolucionária que descreve o comportamento da matéria em escala atômica e subatômica. A mecânica quântica substituiu a ideia de órbitas precisas por uma descrição probabilística da localização dos elétrons.
Este novo paradigma representou uma profunda mudança de perspectiva, abandonando a física clássica newtoniana em favor de um universo regido por probabilidades e quantização de energia.
O Princípio da Incerteza de Heisenberg e suas Consequências
Uma das pedras angulares da mecânica quântica é o princípio da incerteza de Heisenberg, enunciado por Werner Heisenberg em 1927. Este princípio estabelece um limite fundamental para a precisão com que podemos conhecer simultaneamente a posição e o momento (massa vezes velocidade) de uma partícula.
ΔxΔp ≥ h/4π
onde Δx representa a incerteza na posição, Δp a incerteza no momento, e h é a constante de Planck. Em outras palavras, quanto mais precisamente conhecemos a posição de um elétron, menos precisamente conhecemos sua velocidade, e vice-versa. Esta limitação inerente à natureza impossibilita a descrição de órbitas eletrônicas bem definidas, como proposto no modelo de Bohr, pois a própria noção de órbita implica um conhecimento preciso da posição e do momento do elétron ao longo do tempo.
Orbitais Atômicos versus Órbitas de Bohr
O modelo de Bohr descreve os elétrons como partículas que se movem em órbitas circulares ao redor do núcleo, assemelhando-se a planetas orbitando o Sol. A mecânica quântica, por outro lado, descreve a localização dos elétrons através de orbitais atômicos. Um orbital atômico não é uma órbita definida, mas sim uma região do espaço ao redor do núcleo onde existe uma alta probabilidade de encontrar um elétron.
Cada orbital é caracterizado por um conjunto de números quânticos que definem sua forma, energia e orientação espacial. A visualização de um orbital pode ser feita através de mapas de densidade de probabilidade, mostrando regiões de maior e menor probabilidade de encontrar o elétron.
A diferença crucial reside na natureza determinística das órbitas de Bohr versus a natureza probabilística dos orbitais atômicos.
O Modelo Atômico Atual: Nuvens de Elétrons e Probabilidade
O modelo atômico atual é baseado na mecânica quântica e descreve o átomo como um núcleo denso e positivo cercado por uma nuvem de elétrons. Esta nuvem eletrônica representa a região do espaço onde os elétrons têm maior probabilidade de serem encontrados. A densidade da nuvem eletrônica em cada ponto do espaço é proporcional à probabilidade de encontrar um elétron naquele ponto.
A forma e o tamanho da nuvem eletrônica dependem dos orbitais atômicos ocupados pelos elétrons. Assim, a imagem de um átomo com elétrons em órbitas bem definidas é substituída por uma representação probabilística, refletindo a natureza intrinsecamente incerta do mundo quântico. A descrição completa requer o uso de equações complexas da mecânica quântica, mas a imagem da nuvem de elétrons fornece uma visualização intuitiva, embora simplificada, da distribuição eletrônica no átomo.
O modelo atual, portanto, se distancia da simplicidade geométrica do modelo de Bohr, abraçando a complexidade e a beleza da mecânica quântica.

