Reações de Dupla Troca Química: De Um Exemplo De Cada Reaçao Dupla Troca Quimica Brainly
De Um Exemplo De Cada Reaçao Dupla Troca Quimica Brainly – Reações de dupla troca, também conhecidas como reações de metátese, são um tipo comum de reação química onde dois compostos iônicos reagem trocando seus íons para formar dois novos compostos. Essas reações são fundamentais em diversos processos químicos, desde a produção de sais até o tratamento de água. A ocorrência de uma reação de dupla troca depende da formação de um produto insolúvel (precipitado), um gás ou água, deslocando o equilíbrio da reação.
Introdução à Reação de Dupla Troca, De Um Exemplo De Cada Reaçao Dupla Troca Quimica Brainly

Uma reação de dupla troca ocorre quando cátions e ânions de dois compostos iônicos trocam de parceiros, formando novas combinações. A condição essencial para que essa reação aconteça é a formação de um produto insolúvel (precipitado), água, ou um gás, que remove os produtos da solução, deslocando o equilíbrio para a formação dos produtos. Observemos exemplos cotidianos: a formação de queijo a partir do leite (reação com ácido) e a efervescência de um antiácido estomacal ao entrar em contato com o ácido do estômago são exemplos de reações de dupla troca.
| Reagentes | Produtos | Estado Físico dos Reagentes | Estado Físico dos Produtos |
|---|---|---|---|
| NaCl(aq) + AgNO3(aq) | AgCl(s) + NaNO3(aq) | Aquoso, Aquoso | Sólido, Aquoso |
| HCl(aq) + NaOH(aq) | NaCl(aq) + H2O(l) | Aquoso, Aquoso | Aquoso, Líquido |
| Na2CO3(aq) + 2HCl(aq) | 2NaCl(aq) + H2O(l) + CO2(g) | Aquoso, Aquoso | Aquoso, Líquido, Gasoso |
| BaCl2(aq) + Na2SO4(aq) | BaSO4(s) + 2NaCl(aq) | Aquoso, Aquoso | Sólido, Aquoso |
Tipos de Reações de Dupla Troca

As reações de dupla troca podem ser classificadas de acordo com o tipo de produto formado. A formação de um precipitado, água ou gás indica a ocorrência da reação e determina suas características visuais. Reações de neutralização (ácido-base) são um subconjunto específico das reações de dupla troca, onde um ácido reage com uma base para formar sal e água.
- Formação de Precipitado: Observamos a formação de um sólido insolúvel. Exemplo: AgNO 3(aq) + NaCl(aq) → AgCl(s) + NaNO 3(aq)
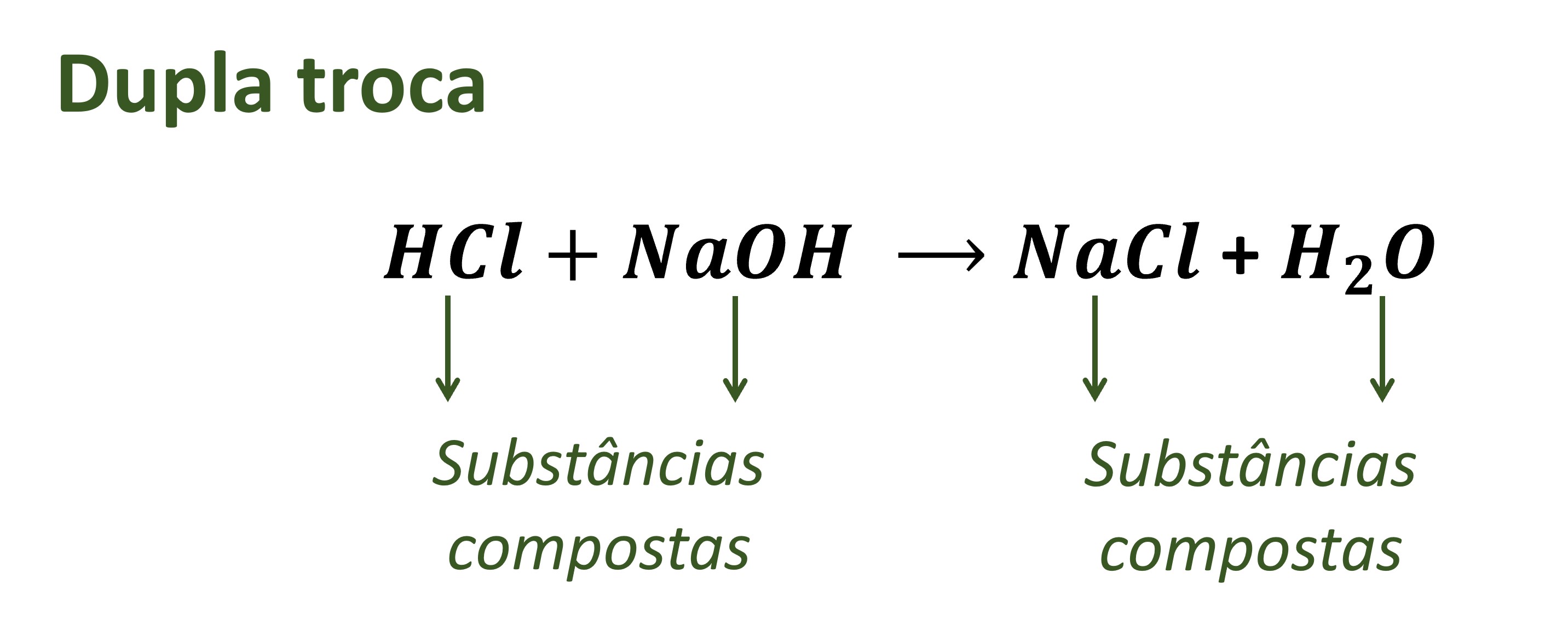
- Formação de Água: Reação de neutralização, com liberação de calor. Exemplo: HCl(aq) + NaOH(aq) → NaCl(aq) + H 2O(l)
- Formação de Gás: Observamos a liberação de bolhas de gás. Exemplo: Na 2CO 3(aq) + 2HCl(aq) → 2NaCl(aq) + H 2O(l) + CO 2(g)
Equacionamento e Balanceamento de Reações de Dupla Troca
O balanceamento de equações químicas é crucial para a conservação da massa, garantindo que o número de átomos de cada elemento seja igual nos reagentes e produtos. Utilizamos o método da tentativa para alcançar o balanceamento, ajustando os coeficientes estequiométricos.
Um exemplo detalhado: Para balancear a equação FeCl 3(aq) + 3NaOH(aq) → Fe(OH) 3(s) + 3NaCl(aq), verificamos que o número de átomos de cada elemento é igual em ambos os lados da equação.
FeCl3(aq) + 3NaOH(aq) → Fe(OH) 3(s) + 3NaCl(aq)
Aplicações das Reações de Dupla Troca
As reações de dupla troca possuem amplas aplicações na indústria e na vida cotidiana. Sua importância na produção de sais, tratamento de água e outros processos químicos é inegável.
- Produção de Sais: Reações de neutralização são amplamente utilizadas para sintetizar sais com propriedades específicas. Exemplo: A reação entre ácido acético (vinagre) e bicarbonato de sódio (fermento químico) produz acetato de sódio, água e dióxido de carbono.
- Tratamento de Água: Reações de dupla troca são usadas para remover íons indesejáveis da água, como íons metálicos pesados, através da precipitação.
- Indústria de Alimentos: A produção de queijo envolve uma reação de dupla troca entre o leite e o ácido lático, resultando na coagulação das proteínas do leite.
Exemplo detalhado: Na produção de cloreto de prata (usado em filmes fotográficos), a reação entre nitrato de prata e cloreto de sódio resulta na formação de um precipitado branco de cloreto de prata e nitrato de sódio em solução. AgNO 3(aq) + NaCl(aq) → AgCl(s) + NaNO 3(aq)
Precipitação em Reações de Dupla Troca
A formação de um precipitado em uma reação de dupla troca é influenciada pela solubilidade dos produtos. A tabela de solubilidade prevê a formação de precipitados com base na solubilidade dos compostos iônicos em água. Um precipitado é uma substância sólida que se separa de uma solução, geralmente devido à baixa solubilidade.
Exemplo: A reação entre nitrato de prata (AgNO 3) e cloreto de sódio (NaCl) resulta na formação de um precipitado branco de cloreto de prata (AgCl), um composto insolúvel em água. O precipitado é um sólido branco, denso e facilmente visível.
Exploramos, neste estudo, a riqueza e a complexidade das reações de dupla troca química, mostrando como um processo aparentemente simples pode ter implicações profundas em diversas áreas. Da formação de precipitados visíveis a olho nu à produção de sais essenciais para a indústria, compreendemos a importância do balanceamento de equações e a predição de produtos com base na solubilidade dos reagentes.
Esperamos que esta análise tenha fornecido uma visão clara e abrangente deste importante conceito químico, estimulando a curiosidade e o aprofundamento no estudo da química.

